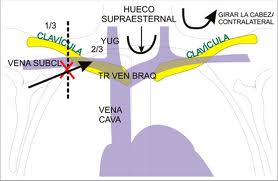
La trombosis venosa del sector axilo-subclavio se estima aproximadamente
de 2 a 4 % de todos los casos de trombosis venosa profunda o tiene una
incidencia de 11 casos cada 100.000 admisiones hospitalarias .
La mayoría de los casos
de trombosis venosa del sector axilo-subclavio son de etiología secundaria, es
decir que están asociados con el estado de hipercoagulabilidad, catéteres
venosos colocados en forma prolongada o una combinación de ambos. Ha habido un
aumento en la incidencia de este tipo de trombosis debido al aumento del uso de
catéteres venosos centrales en la extremidad superior.
La trombosis venosa del
sector axilo-subclavio primaria o síndrome de Paget – Schroëtter, aunque
relativamente rara, es no obstante una complicación potencialmente
incapacitante que compromete el tracto de salida toráxico afectando a individuos
jóvenes sanos y activos.
La trombosis del sector
venoso axilo-subclavio es frecuentemente secundaria a una actividad repetitiva
de la extremidad superior asociada a una anormalidad mecánica de la porción
costo clavicular del sector venoso axilo-subclavio; la vena está estenosada
debido a una compresión extrínseca por una primera costilla o costilla
cervical, un músculo escaleno anterior hipertrofiado o tendón subclavio, o una
combinación de todos. La mayoría de los pacientes estaba desarrollando una
actividad física vigorosa en el momento del episodio del edema , teniendo mayor
riesgo aquellos pacientes que tienen ocupaciones que les determina una
actividad muscular repetitiva.
En el síndrome de Paget
– Schroëtter, cuando ocurre la trombosis venosa, ella puede conducir a una
hipertensión venosa crónica con síntomas recurrentes incapacitantes que ocurren
aproximadamente en 33 – 85 % de los pacientes tratados solo con anticoagulación
y elevación del miembro. Además una pequeña pero definida incidencia de embolia
de pulmón es reportada en 10-12 % de los pacientes (4). Ha sido también
demostrado en estudios previos que aquellos pacientes tratados en forma
conservadora solamente con anticoagulación ( heparina y coumadín ) y elevación
del brazo son los que presentan mayor incidencia de complicaciones tardías como
edema residual del brazo, dolor, embolias pulmonares, y tromboflebitis
superficial. (5).
Sin embargo, los
pacientes cuyas venas trombosadas han sido repermeabilizadas pasaron mejor
clínicamente que aquellos con obstrucción persistente (6).
Aunque éstos trabajos
evidencian la urgencia en estos casos de utilizar tratamientos trombolíticos,
la estrategia terapéutica más eficaz para el síndrome de Paget- Schroëtter
permanece controversial. Aunque la trombolisis realizada con urokinasa mejora
la permeabilidad venosa y reduce los síntomas ( especialmente cuando este
tratamiento es iniciado dentro de los diez días del comienzo de los síntomas)
(7) , a pesar de ésta estrategia agresiva, de urgente implementación del
tratamiento lítico, 20 % de los casos no tienen éxito en obtener la
permeabilidad de la vena (8).
Existe consenso entre
los autores que un diagnóstico temprano ( antes de un mes del comienzo) y un
tratamiento trombolítico expeditivo provee los resultados más favorables ( 9,
10). Es así que mientras es monitorizado en una unidad de cuidado intensivo, el
paciente debe recibir ya sea TPA o Retaplase hasta que una nueva flebografía
verifique la disolución del trombo o su no propagación. Las opiniones, difieren
sin embargo, en relación a la necesidad y la oportunidad de la intervención
quirúrgica. En 1993 Marsh Leder (11) propuso retardar la recesión de la primer
costilla hasta tres meses después de la trombolisis para evitar la trombo
génesis. En 1995, Molina (12) fue uno de los primeros en proponer la
trombolisis seguida por una inmediata cirugía. Más recientemente Angler y
colaboradores (13) y Lee y colaboradores (14) independientemente, compararon la
descompresión quirúrgica temprana y tardía, concluyendo, en forma similar, que
la lisis del trombo venoso temprana seguida por una inmediata descompresión
quirúrgica fue la estrategia que provocó mejores resultados clínicos sin
incremento en la morbimortalidad.
Otro grupo propone que
el tratamiento quirúrgico se retarde. Después de un mes de anticoagulación,
únicamente pacientes con síntomas persistentes y obstrucción venosa, deberían
ser los candidatos adecuados para cirugía (15).Cuando la cirugía está indicada,
la mayoría de los autores está de acuerdo en que la escalenectomía,la disección
de la primera costilla, y la lisis venosa, deberían ser realizadas durante el
mismo procedimiento. El abordaje transaxilar o supraclavicular podrían ser
usados por el cirujano según su preferencia.
Kreienberg y colaboradores
(16) han recientemente propuesto un algoritmo de tratamiento que asocia a la
trombolisis simultáneamente con la cirugía, y la angioplastia transluminal
percutánea, con colocación de stent en pacientes en que se demuestra una
estenosis venosa residual ( post cirugía) mayor del 50 % . Las ventajas de una
estrategia expeditiva son un más rápido retorno a la actividad normal del
paciente, un período más abreviado de anticoagulación, minimizar el riesgo de
trombosis recurrente y la potencial posibilidad de reducir la competencia de
flujo de las venas colaterales que pueden en forma adversa afectar la
permeabilidad de la vena subclavia. En la serie de 23 pacientes de éstos
autores, las complicaciones incluyeron 3 hematomas que requirieron drenaje y
una Toracotomia para descompresión.
La mutación del factor V
de Leyden estuvo presente en 3 de 5 pacientes con re trombosis, sugiriendo la
importancia potencial de realizar el screening del factor V de Leyden si uno
está considerando la posibilidad de colocar un stent. (16) Un estudio
retrospectivo reciente por Heron y colaboradores (17) , sin embargo, encontró
que la mutación del factor V de Leyden está solo en el 5% de los pacientes con
síndrome de Paget-Schroëtter, correspondiéndose con la prevalencia de éste alelo
en las poblaciones europeas.
El rol de la
angioplastia y del stent es también controversial, fundamentalmente debido a la
pobreza de estudios de seguimiento.. La mayoría de los autores esta de acuerdo
en que la angioplastia no debería ser realizada inmediatamente después de una
trombolisis exitosa cuando queda una estenosis residual debido a una compresión
extrínseca.(18). Después que la lisis y una cirugía de decomprensión han sido
realizadas, y persiste una estenosis residual, la angioplastia con o sin stent
podría estar indicada para prevenir una re trombosis (16). Es esencial también
evaluar y objetivar el grado de incapacidad del paciente para guiar las
decisiones terapéuticas.
Lokanathan y
colaboradores (19) recientemente propuso usar un cuestionario como herramienta
para identificar a aquellos pacientes con síntomas menores en quienes una
estrategia no quirúrgica después de la trombosis inicial puede ser apropiada.
Sin embargo, para aquellos pacientes con síntomas que le impiden trabajar o
realizar actividades recreacionales, la cirugía y la angioplastia con stent
deberían ser consideradas como una opción de tratamiento.
Una revisión de la
literatura apoya dos estrategias de tratamiento. La primera es expeditiva,
combinando una trombolisis temprana seguida inmediatamente por cirugía y
angioplastia o Stenting si una estenosis residual es constatada en la
flebografía de control luego de la cirugía. Esta opción reduce la duración del
tratamiento y la inactividad del paciente y se dice que aumenta la probabilidad
de mantener la permeabilidad venosa con menos síntomas residuales. La segunda
opción consiste en una trombolisis temprana seguida por un período de un mes de
tratamiento con Coumadín para seleccionar solo aquellos pacientes sintomáticos
que serían los que deberían ser tratados con cirugía con o sin angioplastia con
stent. Basar la estrategia terapéutica en los síntomas clínicos del paciente
parece más juicioso, para tratar de evitar procedimientos invasivos
potencialmente incapacitantes y que provocan morbilidad.
Sin embargo, el
mantenimiento de la permeabilidad venosa pude ser puesta en peligro por el
retardo de la intervención durante el intervalo de observación.
Urschel y Razzuq (10)
publicaron la más grande serie retrospectiva de pacientes portadores de
síndrome de Paget-Schroëtter en una experiencia de treinta años de seguimiento,
incluyendo 312 extremidades en 294 pacientes. Ellos reportaron que los mejores
resultados en la obtención de permeabilidad venosa y mejoría clínica estuvo en
el grupo de 199 de 241 pacientes quienes fueron tratados antes de los 6 semanas
de la trombosis usando agentes trombolíticos con la subsiguiente rápida
recesión de la primera costilla.En los restantes que no fueron evaluados hasta
después de seis semanas del comienzo de la oclusión venosa a pesar de los
intentos para recanalizar las venas trombosadas ninguna pudo ser abierta y a
pesar de la recesión de la primera costilla la mayor parte de los pacientes
permanecieron sintomáticos.
De los 35 pacientes
iniciales tratados con tratamiento anticoagulante ( Heparina, coumadina), 26
experimentaron una recurrencia en los síntomas después de comenzar a trabajar,
con una mayoría 21,que persistieron con secuelas a pesar de la recesión de la
primera costilla. Estas observaciones apoyan en forma entusiasta realizar un
rápido diagnóstico y tratamiento de los pacientes con síndrome de
Paget-Schroëtter realizando una flebografía temprana, un tratamiento
trombolítico inmediato y también posteriormente una rápida reseción de la
primera costilla trans axilar y descompresión neurovascular.
El grado de obstrucción
venosa se ha correlacionado bien con la persistencia y severidad de los
síntomas (5). Por eso uno de los fines primordiales del tratamiento es re
permeabilizar las venas obstruidas. Cuando el tratamiento se retarda más allá
de los dos meses ya sea por no realizar un diagnostico acertado o que el
paciente no consulta en forma rápida, la probabilidad de restaurar el sistema
venoso y de mejorar el pronostico clínico esta muy comprometido. El trombo
agudo fresco de diez días de maduración es mucho más probable que responda al
tratamiento trombolítico que el trombo crónico.
La estrategia optima de
tratamiento para el síndrome de Paget-Schroëtter permanece siendo motivo de
debate. Existe indudablemente necesidad de un estudio multicéntrico para
estudiar diferentes regímenes de tratamiento para tratar de identificar el
algoritmo más eficaz combinando trombolisis, cirugía, angioplastia, Stenting y
anticoagulación. Indudablemente un rápido y adecuado diagnostico para
identificar una trombosis inducida por el esfuerzo como etiología de la
trombosis venosa del sector venoso axilo-subclavio es de importancia
primordial. Una rápida trombolisis local es ahora universalmente aceptado.. Las
opciones terapéuticas propuestas deberían ser discutidas con el paciente en
forma individual para que la calidad de vida sea esencial para determinar la
relación riesgo más beneficio más favorable. En el momento actual dispositivos
de trombo aspiración ( Angiojet. X-SIZER) son también de estimable ayuda
asociados a los trombolíticos para tratar de re permeabilizar este sector
venoso.
Referencias
- Paget J. Practice among the out – patients of St
Bartholomew ´s Hospital : III, on some affections on voluntary muscles. Med Times Gazette
1858; 16:260-261
- Von Schröetter L. Erkrankungen der Gafabe. In:
Nothnagel H. editor.Specielle Pathologie und Therapie, XV, II, Theil II. Halfe: Erkrankungen
der Venen. Viena: Holder; 1899, p 533-535.
- Prandoni, P.
Polistena P, Bernardi,E, Cogo, A.Casara D, Verlat F, Amgelini F, Simioni
P, Signorini GP, Benedetii L, Girolami A, Upper-extermity deep vein
thrombosis: risk factor, diagnosis and complications. Arch Int Med
1997;157:57-62
- Harley DP, White RA, Nelson RJ, Mehringer LM.
Pulmonary embolism secondary to venous thrombosis of the arm. Am J Surg
1984;147;221-224
- De Weese Ja, Adams JT, Gaiser DL, Subclavian
venous thrombectomy. Circulation 1970;41 (5 Suppl) :II 158-II164.
- Rubenstein M, Creger WP. Successful streptokinase
therapy for catheter – induced subclavian vein thrombosis. Arch Int Med
1980;140:1370-1371.
- Drury EM, Trout HH,Giordano JM, Hix WR. Lytic
therapy in the treatmente of axillary and subclavian vein thrombosis. J Vase Surg
1985:2:821-827.
- AbuRahma AF, Sadler D, Stuart P, Khan MZ, Boland
JP, Convencional versus thrombolytic therapy in spontaneous ( effort)
axillary-subclavian vein trombosis . Am J Surg 1991;57:101-107.
- Kunkel JM, Machleder HI, Treatment of
Paget-Schröetter syndrome: a staged, multidisciplinary approach.Arch Surg 1989;124:1153-1158.
- Urschel HC Jr, Razzuk MA. Paget-Schröetter
syndrome : What is the best management? Ann Thorac Surg 2000;69:1663-1669.
- Machleder HI. Evaluation of a new treatment
strategy for Paget-Schröetter syndrome: spontaneous thrombosis of the axillary
subclavian vein. J
Vase Surg 1993;17:305-317.
- Molina JE. Need for emergency treatment in
subclavian vein effort thrombosis . Am J Coll Surg 1995;181:414-420.
- Angle N, Gelabert HA, Farooq MM. Ahn SS, Cardwell
DR. Freischlag JA, Machleder HI, Safety and efficacy of early surgical
decompression of the thoracic outlet for Paget-Schröetter syndrome. Ann Vase Surg
2001;15:37-42
- Lee MC, Gras CJ, Belkin M, Mannick JA, Whittemore
AD, Donaldson MC, Early operative intervention after thrombolysis therapy
for primary subclavian thrombosis: an effective treatment approach. J Vase Surg
1998;27:1101-1108.
- Lee WA, Hill BB, Harris EJ, Semba CP, Olcott C ,
Surgical intervention is not required for all patients with subclavian
vein trombosis. J
Vase. Surg 2000;32-57-67
- Kreienberg PB, Chang BB, Darling RL, Roddy SP,
Paty PSK, Lloyd WE, Cohen D, Stainken B, Shah DM, lLong-term results in
patients treated with thrombolysis. Thoracic inlet decompression. And
subclavian vein stenting fot Paget Schröetter syndrome. J Vase Surg 2001;33:5100-5105.
- Héron E, Lozinguez O, Alhenc-Gelas M Emmerich J,
Fiessenger JN, Hypercoagulable states in primary upper extremitiy deep
venous trombosis. Arch
Intern Med 2000;160:382-386.
- Rutherfod, RB. Primary subclavian axillary vein
thrombosis: the relative rolses of thrombolysis, percutaneous angioplasty,
stents and surgery. Semin
Vase Surg 1998;11:91-95.
- Lokanathan R, Salvian AJ, Chen JC, Morris c,
Taylor DC, Hsiang N. Outcome after thrombolysis and selective thoracic
oulet decompression for primary axillary vein thrombosis. J Vase Surg
2001;33:783-788
Autor: Marie-Antoinette Sevestre,md, Christoph Kalka,md, William T
Irwin, Heideh K Ahari,md and Robert M Schainfeld, DO
Fuente:Catheterization and Cardiovascular Interventions 59:71-76 (2003)